Simply explained: Drug approval procedures in Europe and the example of COVID-19 vaccines
German version below

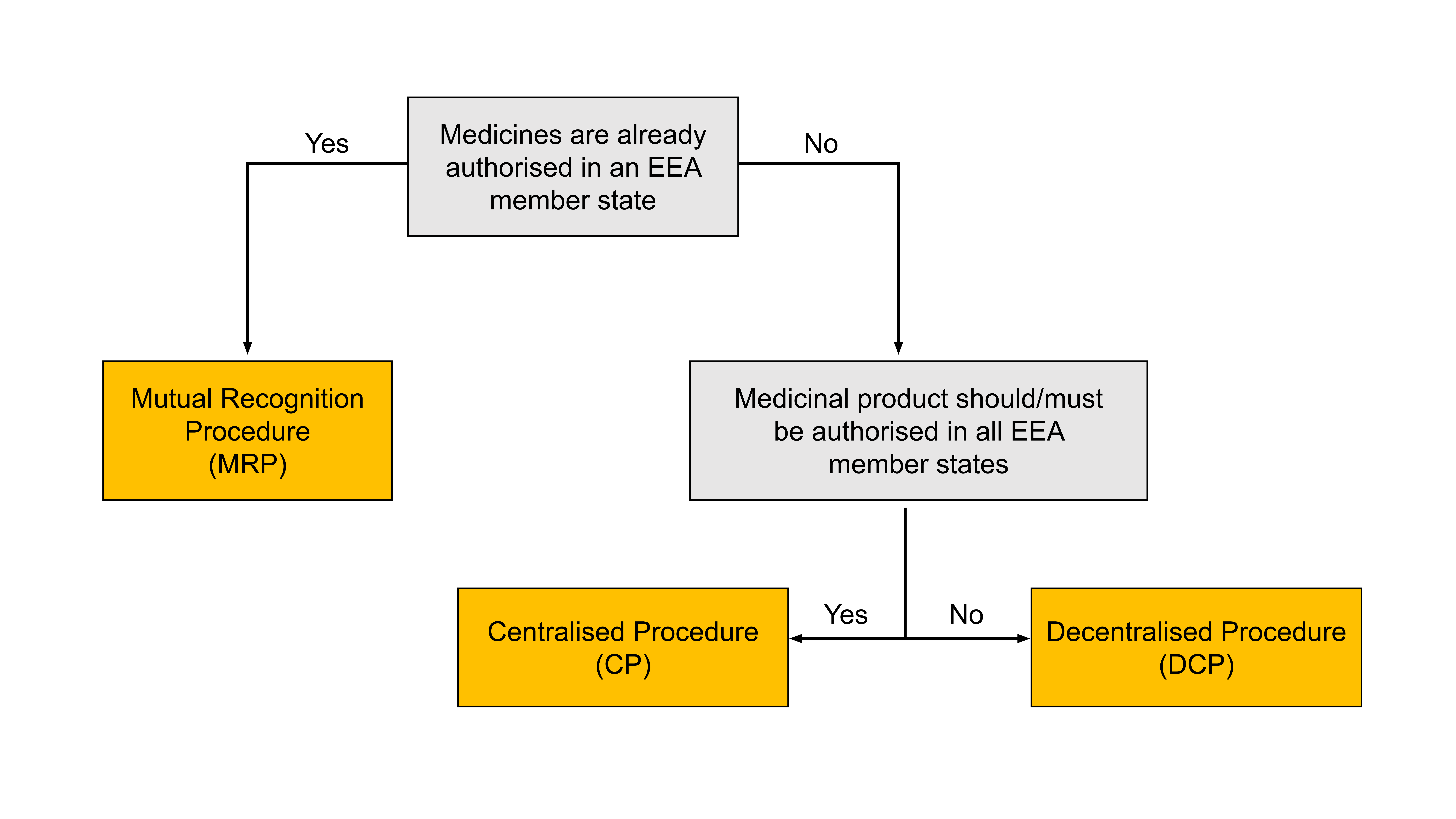
Summary: There are three different marketing authorisation procedures in Europe: the Centralised Procedure (CP), the Decentralised Procedure (DCP) and the Mutual Recognition Procedure (MRP). In the case of CP, marketing authorisation takes place in all member states of the European Economic Area (EEA). The CP is mandatory for many drug approvals. In the case of the MRP, a drug is already approved in a member state of the EEA, the reference member state (RMS), for the approval in other countries. The DCP serves to approve the drug only in certain EEA member states. In the pandemic case of drug approvals against COVID-19, shortened regulatory procedures contributed to the short-term availability of vaccines.
Involved organizations and their roles
The central player in the approval process is the EMA, founded in 1995 with the task of guaranteeing the scientific assessment of pharmaceutical products. The EMA’s core mission is to coordinate and plan scientific resources for the assessment, monitoring and pharmacovigilance of drugs.
The scientific resources include, among others, a pool of advisors consisting of experts from different disciplines. Scientific committees carry out the evaluation of a drug:
The committees are composed of experts from national authorities of the EEA. In Germany, the national authorities are the Federal Institute for Drugs and Medical Devices (Bundesinstitut für Arzneimittel und Medizinprodukte [BfArM]) and the Paul Ehrlich Institute (PEI).
The committees have two objectives:
Based on the assessment of the EMA, the European Commission (EC) decides on the approval of a new treatment option in the EEA. In addition, the EC may amend or suspend existing marketing authorisations. As part of its legislative function, the EC proposes legislation for the pharmaceutical industry and monitors compliance with pharmaceutical legislation.
Approval procedures – (focus on human drugs)
1. Centralised Procedure (CP)
The CP enables simultaneous approval of new treatment options for patients in all member states of the EEA. The pharmaceutical company submits a single application for approval. The EMA carries out a scientific assessment. For this purpose, the CHMP appoints two rapporteurs (Rapporteur and Co-Rapporteur) from different member states to prepare a scientific report. A peer review process may take place to ensure scientific reasoning. Other CHMP members comment on the report and consolidate it. Furthermore, they prepare a List of Questions (LoQ) that the applicant must answer. During this time, the deadline for the evaluation of a drug is officially stopped (Clock-stop). The CHMP adjusts the assessment based on the answers and comments from CHMP members. Often, CHMP creates another LoQ that pharmaceutical companies answer during a second Clock‑stop.
If there are further uncertainties, CHMP may request hearings with the pharmaceutical company and form working groups to address specific questions. At the end of the procedure, the CHMP drafts a scientific conclusion with a recommendation on whether and under what conditions a drug should be approved. CHMP adopts it by consensus or by majority vote. In addition, the CHMP agrees on the wording of the product information and other data that must be available after the drug approval. Based on the CHMP’s recommendation, the EC makes the approval decision.
The CP is mandatory in the case of:
2. Mutual Recognition Procedure (MRP)
In the MRP, a marketing authorisation for the corresponding medicinal product already exists in an EEA member state. This serves as the basis for the marketing authorisation in other member states. Within 90 days, representatives of the national authorities prepare the assessment report based on the existing marketing authorisation. Representatives of the other member states (Concerned Member States [CMS]) in the CHMP review the report. Once the assessment report is accepted, marketing authorisation is granted in all member states of the EEA.
3. Decentralised Procedure (DCP)
The DCP covers medicinal products that are not included in the CP and for which no marketing authorisation exists in any EEA member state. Under this procedure, the pharmaceutical company applies for marketing authorisations in the desired EEA member states. In this case, the pharmaceutical company chooses the Reference Member State (RMS). The members of the according RMS institution fulfil similar tasks as rapporteur and co-rapporteur at the CP.
They are responsible for the scientific assessment of the drug, procedural coordination, and preparation of the assessment report. The assessment report is prepared within 120 days and forwarded to CMS representatives. In the following phase, CMS representatives evaluate the available documents within a period of 90 days. If they don´t find any serious risk to public health, they agree with the final assessment report and issue national approvals after the DCP is completed.
Specifics of COVID-19 vaccine approval
Many people were sceptical when the first COVID-19 vaccines were approved, in part because of the short time frame of introduction and availability compared to other vaccines. How was it possible, that vaccines were available just one year after the start of the pandemic?
A number of important reasons for the accelerated availability of vaccines stem from the specific pandemic situation of COVID-19. On the one hand, research regarding vaccines of related viruses was already at an advanced level. Furthermore, immense resources were devoted to research activities worldwide and collaborations formed. The rapidly increasing incidence could accelerate patient recruitment. As a result, faster study completions were possible. Additionally, vaccine production took place in parallel with the approval process.
Regulatory reasons: Resources and accelerated procedures by EMA
Regulatory procedures are also responsible for the rapid availability of the first COVID-19 vaccines. With the emergence of COVID-19, the EMA formed an expert group to advise applicants both scientifically and on regulatory procedures. Acceleration of approval can occur through a rolling review, which occurs prior to submission of the marketing authorisation application and complete data set. This means that during phase III studies, the EMA already reviews individual parts of the dossier to be submitted. This gives the applicant the opportunity to answer any questions that may already arise. In addition to the rolling review, there is an accelerated approval procedure for conditional approvals. This procedure can reduce the period between submission and final approval from 277 to 153 days. A conditional approval is valid for one year, after which it can be extended for another year and, if necessary, become fully approved. This is subject to a positive risk-benefit balance and the condition that the pharmaceutical company provides further comprehensive data later on. The conditional approval underlies EU legislation in the case of public health emergencies.
Timing of the central procedure (CP)
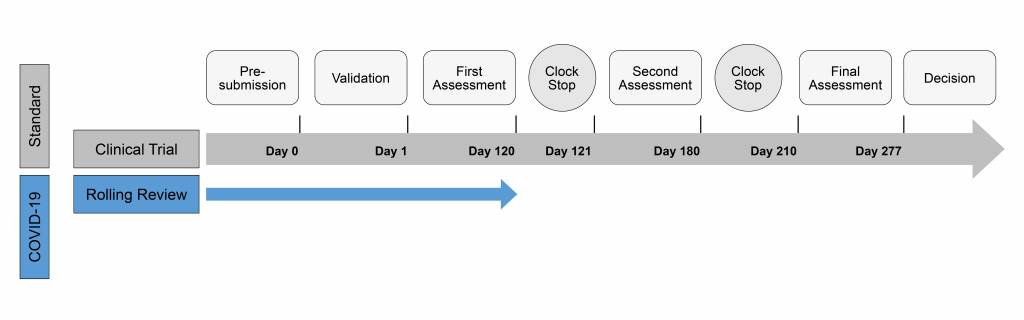
GKM, 2022
Conclusion
The goal of drug approval is to weigh benefits versus risks by evaluating therapeutic efficacy and safety. Three different approval procedures exist in order to standardize the procedure for drug approval between the member states of the EEA. These involve experts from all over Europe and are subject to time and content regulations. In the pandemic case of drug approvals against COVID-19, shortened regulatory procedures contributed to the short-term availability of vaccines.
Abbreviations:
| BfArM | Bundesinstitut für Arzneimittel und Medizinprodukte |
| CAT | Committee for Advanced Therapies |
| CHMP | Committee for Medicinal Products for Human Use |
| CMS | Concerned Member States |
| COMP | Committee for Orphan Medicinal Products |
| CP | Centralised Procedure |
| CVMP | Committee for Veterinary Medicinal Products |
| DCP | Decentralised Procedure |
| EC | European Commission |
| EEA | European Economic Area |
| HMPC | Committee for Herbal Medicinal Products |
| LoQ | List of Questions |
| MRP | Mutual Recognition Procedure |
| PDCO | Peadiatric Committee |
| PEI | Paul Ehrlich Institute |
| PRAC | Pharmacovigilance Risk Assessment Committee |
| RMS | Reference Member State |
Einfach erklärt: Arzneimittelzulassungsverfahren in Europa und das Beispiel von COVID-19 Arzneimitteln

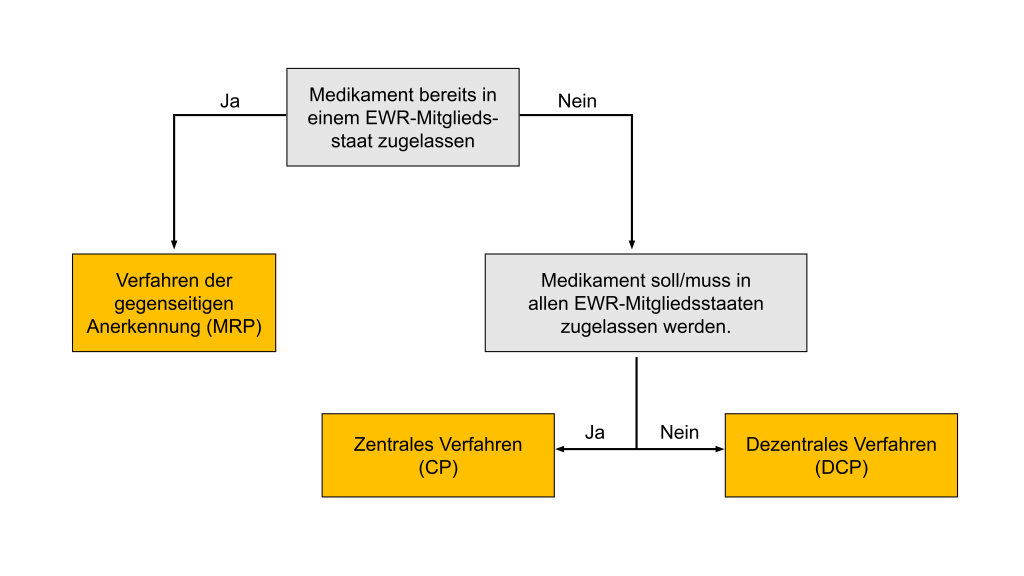
Zusammenfassung: Es gibt mit dem zentralen Verfahren (Centralised Procedure [CP]), dem dezentralem Verfahren (Decentralised Procedure [DCP]) und dem Verfahren der gegenseitigen Anerkennung (Mutual Recognition Procedure [MRP]) drei unterschiedliche Arzneimittelzulassungsverfahren in Europa. Erfolgt die Zulassung mittels CP, so darf das entsprechende Arzneimittel in allen Mitgliedsstaaten des Europäischen Wirtschaftsraums (EWR) vertrieben werden. Der zeitliche Ablauf ist hierbei strikt vorgegeben und für viele Medikamentenzulassungen obligatorisch. Beim MRP liegt bereits eine Medikamentenzulassung in einem Mitgliedsstaat des EWR vor, sodass dieser als Referenzstaat (Reference Member State [RMS]) für die Zulassung in anderen Ländern gilt. Das DCP findet Anwendung, wenn das Medikament nur in bestimmten Mitgliedsstaaten von EWR zugelassen werden soll.
Beteiligte Organisationen und ihre Funktionen
Zentraler Akteur im Zulassungsverfahren ist die EMA, gegründet 1995 mit der Aufgabe, die wissenschaftliche Beurteilung von Arzneimitteln zu garantieren. Der Kernauftrag der EMA ist die Koordination und Planung wissenschaftlicher Ressourcen zur Beurteilung, Überwachung und Pharmakovigilanz von Arzneimitteln.
Zu den wissenschaftlichen Ressourcen zählt unter anderem ein Beraterpool, bestehend aus Sachverständigen unterschiedlicher Fachrichtungen. Die wissenschaftliche Beurteilung eines Arzneimittels wird von wissenschaftlichen Ausschüssen der EMA durchgeführt:
Die Ausschüsse setzen sich aus Experten zusammen, die von den zuständigen nationalen Behörden des EWR entsandt werden. In Deutschland sind die nationalen Behörden das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) und das Paul-Ehrlich-Institut (PEI).
Die Ausschüsse verfolgen zwei Ziele:
Die Europäische Kommission entscheidet basierend auf der Beurteilung der EMA über das Inverkehrbringen einer neuen Behandlungsmöglichkeit für Patient*innen im EWR. Darüber hinaus darf die Europäische Kommission bereits bestehende Genehmigungen ändern oder aussetzen. Im Rahmen ihrer Gesetzgebungsfunktion schlägt die Europäische Kommission Rechtsvorschriften für die Pharmaindustrie vor und überwacht die Einhaltung des Arzneimittelrechts.
Die verschiedenen Zulassungsverfahren – Fokus Humanarzneimittel
1. Zentralen Verfahren (Centralised Procedure [CP])
Das CP ermöglicht eine simultane Zulassung von neuen Behandlungsmöglichkeiten für Patient*innen in allen Mitgliedsstaaten des EWR. Das pharmazeutische Unternehmen stellt dafür einen einzigen Antrag auf Genehmigung. Die EMA führt eine wissenschaftliche Beurteilung durch. Dafür werden vom CHMP zwei Berichterstatter (Rapporteur und Co-Rapporteur) aus unterschiedlichen Mitgliedsstaaten ernannt, die einen wissenschaftlichen Bericht erarbeiten. Zur Sicherstellung der wissenschaftlichen Argumentation kann ein Peer-Review-Verfahren stattfinden. Der Bericht wird von den anderen CHMP-Mitgliedern kommentiert und konsolidiert. Ein Fragenkatalog (List of Questions [LoQ]) wird erstellt, welcher vom Antragssteller beantwortet wird. In dieser Zeit wird die Frist zur Bewertung eines Arzneimittels offiziell gestoppt (Clock‑stop).
Die Beurteilung wird basierend auf den Antworten angepasst und Kommentare von den CHMP-Mitgliedern werden erneut in den Bericht integriert. Oft wird eine weitere LoQ gestellt, die während eines zweiten Clock‑stops beantwortet wird. Zudem können bei weiteren Unklarheiten eine mündliche Anhörung mit dem pharmazeutischen Unternehmen eingefordert und Arbeitsgruppen für spezifische Fragestellungen gebildet werden. Zum Verfahrensende entwirft das CHMP ein wissenschaftliches Gutachten mit einer Empfehlung darüber, ob und unter welchen Bedingungen ein Arzneimittel zugelassen werden soll. Dieses wird im Konsens oder per Mehrheitsmeinung verabschiedet. Zusätzlich einigt sich das CHMP auf den Wortlaut der Produktinformation sowie weitere Daten, die nach der Zulassung des Arzneimittels vorliegen müssen. Auf Basis der Empfehlung des CHMP trifft die Europäische Kommission die Zulassungs-Entscheidung.
Das CP ist verpflichtend für:
2. Verfahren der gegenseitigen Anerkennung (Mutual Recognition Procedure [MRP])
Beim MRP liegt bereits eine Zulassung für das entsprechende Arzneimittel in einem EWR‑Mitgliedsstaat vor, welche als Basis zur Zulassung in anderen Mitgliedsstaaten dient. Innerhalb von 90 Tagen erstellen Vertreter*innen der nationalen Behörden mit der vorliegenden Zulassung den Bewertungsbericht. Dieser wird daraufhin zur Überprüfung und Annahme an Vertreter der anderen Mitgliedsstaaten (Concerned Member States [CMS]) im CHMP weitergeleitet. Ist die Anerkennung des Bewertungsberichts erfolgt, so folgt die Erteilung der Zulassung in allen Mitgliedsstatten des EWR.
3. Dezentralem Verfahren (Decentralised Procedure [DCP])
Das DCP kann bei Arzneimitteln angewendet werden, die nicht verpflichtend unter das CP fallen und für die noch keine Zulassung in einem EWR-Mitgliedstaat vorliegt. Das pharmazeutische Unternehmen beantragt bei diesem Verfahren die Zulassungen in den gewünschten Mitgliedsstaaten des EWR. Die Wahl des Landes, dessen Beauftragte den Bewertungsbericht erstellen (Reference Member State [RMS]) obliegt hierbei auch dem Unternehmen. Die Mitglieder der zuständigen Institution des RMS erfüllen ähnliche Aufgaben wie Rapporteur und Co-Rapporteur beim CP.
Das heißt, sie sind zuständig für die wissenschaftliche Beurteilung des Medikaments, die Verfahrenskoordination und die Ausarbeitung des Bewertungsberichts. Diese Beurteilung wird innerhalb von 120 Tagen angefertigt und an die Vertreter der CMS weitergeleitet. Diese können bereits in diesen 120 Tagen aufkommende Fragen formulieren und an den RMS richten. In der darauffolgenden Phase müssen die CMS die vorliegenden Dokumente in einem Zeitraum von 90 Tagen bewerten. Liegt aus Sicht der CMS keine ernsthafte Gefahr für die öffentliche Gesundheit vor, so stimmen sie dem abschließenden Bewertungsbericht zu und erteilen nach der Beendigung des DCPs in einem Zeitraum von 30 Tagen nationale Zulassungen.
Aktuelles Beispiel und Besonderheiten bei der Zulassung von COVID-19 Impfstoffen
Viele Menschen waren bei der Zulassung der ersten COVID-19-Impfstoffe skeptisch, unter anderem aufgrund der kurzfristigen Einführung und Verfügbarkeit im Vergleich zu anderen Impfstoffen. Wie war es denn möglich, dass bereits ein Jahr nach Pandemiebeginn die Vakzine zur Verfügung standen?
Inhaltliche Gründe
Eine Reihe von wichtigen Gründen für die beschleunigte Verfügbarkeit von Impfstoffen ergibt sich aus der spezifischen pandemischen Situation der COVID-19 Erkrankung. Einerseits gab es einen bereits fortgeschrittenen Forschungsstand bezüglich Vakzine verwandter Viren. Zudem wurden weltweit immense Ressourcen für Forschungsaktivitäten eingesetzt und Kooperationen gebildet. Durch die schnell ansteigende Inzidenz konnten schnell ausreichend viele Patienten für die Studiendurchführung gewonnen werden. Dadurch war ein schnellerer Studienabschluss möglich. Des Weiteren wurde die Produktion bereits parallel zum Zulassungsverfahren initiiert.
Regulatorische Gründe: Ressourcen und beschleunigte Verfahren vonseiten der EMA
Darüber hinaus sind aber auch regulatorische Gründe verantwortlich für die rasche Verfügbarkeit der ersten COVID-19-Impfstoffe. Mit dem Auftreten von COVID-19 wurde eine Experten-Gruppe bei der EMA gebildet, welche Antragssteller sowohl wissenschaftlich als auch in Bezug auf Zulassungsverfahren berät. Eine Beschleunigung der Zulassung kann durch ein Rolling Review Verfahren stattfinden, welches noch vor der Einreichung des Zulassungsantrages und dem kompletten Datensatz erfolgt. Es beinhaltet, dass während der Phase-3-Studien bereits Überprüfungen einzelner Teile des einzureichenden Dossiers vonseiten der EMA erfolgen. Der Antragssteller hat damit die Möglichkeit, bereits auftretende Fragen zu beantworten. Neben dem Rolling Review Verfahren gibt es ein beschleunigtes Zulassungsverfahren für bedingte Zulassungen. In diesem Verfahren kann der Zeitraum zwischen Einreichung und finaler Zulassung von 277 auf 153 Tage verkürzt werden. Eine bedingte Zulassung ist ein Jahr lang gültig und kann nach Ablauf dieser Zeit um ein weiteres Jahr verlängert werden und gegebenenfalls in eine Vollzulassung übergehen. Voraussetzung ist ein positives Nutzen-Risiko-Verhältnis sowie die Bedingung, dass zu einem späteren Zeitpunkt weitere umfassende Daten eingereicht werden und ein bisweilen nicht gedeckter medizinischer Bedarf bedient wird. Der bedingten Zulassung zu Grunde liegen EU-Rechtsvorschriften im Falle von Notfällen in der öffentlichen Gesundheit.
Zeitlicher Ablauf des zentralen Verfahrens (CP)
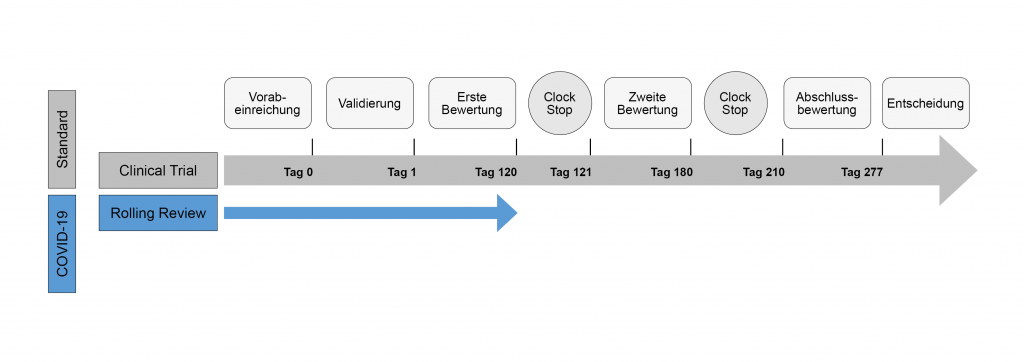
Eigene Darstellung, 2022
Fazit
Das Ziel der Arzneimittelzulassung ist die Abwägung von Nutzen versus Risiko durch die Evaluation von therapeutischer Wirksamkeit und Unbedenklichkeit. Um das Verfahren für die Arzneimittelzulassung zwischen den Mitgliedsstaaten des EWR zu vereinheitlichen, wurden drei unterschiedliche Zulassungsverfahren entwickelt. Diese involvieren Expertinnen und Experten aus ganz Europa und unterliegen zeitlichen sowie inhaltlichen Vorschriften. Im Pandemiefall von Arzneimittelzulassungen gegen COVID-19 konnte die kurzfristige Verfügbarkeit von Impfstoffen unter anderem durch einen verkürzten regulatorischen Verfahrensablauf adressiert werden.
Abkürzungsverzeichnis:
| Abb. | Abbildung |
|---|---|
| BfArM | Bundesinstitut für Arzeimittel und Medizinprodukte |
| CAT | Ausschuss für neuartige Therapien |
| CHMP | Ausschuss für Humanarzneimittel |
| CMS | Concerned Member States |
| CP | Zentrales Zulassungsverfahren (Centralised Procedure) |
| CVMP | Ausschuss für Tierarzneimittel |
| DCP | Dezentralisiertes Verfahren (Decentralised Procedure) |
| EMA | European Medicines Agency |
| EPAR | öffentlicher Beurteilungsbericht (European public assessment report) |
| EU | Europäische Union |
| EWR | Europäischer Wirtschaftsraum |
| HMPC | Ausschuss für pflanzliche Arzneimittel |
| LoQ | List of Questions |
| MRP | Verfahren der gegenseitigen Anerkennung (Mutual Recognition Procedure) |
| PDCO | Pädiatrieausschuss |
| PEI | Paul-Ehrlich-Institut |
| PRAC | Beratender Ausschuss für die Bewertung im Bereich der Pharmakovigilanz |
| RMS | Referenzstaat (Reference Member State) |
Literature
https://www.ema.europa.eu/en/human-regulatory/marketing-authorisation/evaluation-medicines-step-step
https://www.ema.europa.eu/en/committees/how-committees-work
https://www.dzif.de/de/entwicklung-von-impfstoffen
https://www.pei.de/DE/service/faq/coronavirus/faq-coronavirus-node.html
https://ec.europa.eu/commission/presscorner/detail/de/qanda_20_2390
https://www.nature.com/articles/d41586-020-03626-1
https://www.infektionsschutz.de/coronavirus/schutzimpfung/entwicklung-und-zulassung/
Picture: @Artinun/AdobeStock.com
Autoren: Lena Schmidbauer, Sarah Horacek, Michael Obermeier









