Post-Market Clinical Follow-up zur Generierung klinischer Daten nach Inverkehrbringen

Warum wird die klinische Nachbeobachtung, das sogenannte Post-Market Clinical Follow-up (PMCF) so wichtig im Rahmen der Überwachung nach dem Inverkehrbringen? Welche Möglichkeiten gibt es, PMCF durchzuführen, und welche Bedeutung haben die Ergebnisse aus dem PMCF für die klinische Bewertung nach Inverkehrbringen? Informieren Sie sich über die Vorgaben der Medical Device Regulation (MDR) zum PMCF und sammeln sie gezielt, aussagekräftige klinische Daten für Ihre eigenen Medizinprodukte. Diese werden Ihnen als Hersteller helfen, die klinische Evidenz im Rahmen der klinischen Bewertung, unter den Vorgaben der MDR, zu bestätigen.
Die Vorgaben der Medizinprodukteverordnung (MDR) verpflichten die Hersteller zu einer kontinuierlichen klinischen Nachbeobachtung nach Inverkehrbringen, dem sogenannten Post-Market Clinical Follow-up (PMCF). Bedingt ist dies durch die strengeren Maßstäbe an die klinische Bewertung, die kontinuierlich anhand klinischer Daten auch nach Markteinführung zu aktualisieren ist.
Durch die Einschränkungen der klinischen Bewertung nach dem Äquivalenzprinzip kann man die Bewertung künftig nur noch dann auf klinische Daten zu einem äquivalenten Produkt stützen, wenn dieses nachgewiesenermaßen gleichartig zum eigenen Produkt ist – also biologisch, technisch und klinisch äquivalent. Aufgrund dieser Vorgabe in der MDR und der Tatsache, dass die klinische Bewertung auf Basis ausreichender klinischer Daten kontinuierlich zu erfolgen hat, sind die Hersteller verpflichtet, mehr und mehr eigene klinische Daten zu ihren Produkten zu sammeln. Nur so wird es zukünftig möglich sein, im Rahmen der klinischen Bewertung die klinische Evidenz mit den grundlegenden Sicherheits- und Leistungsanforderungen über den Produktlebenszyklus hinweg zeigen zu können.
Hier spielt die kontinuierliche klinische Nachbeobachtung eine wesentliche Rolle. Beim PMCF sammelt und bewertet der Hersteller auf proaktive Art und Weise klinische Daten. Diese werden durch die Anwendung des Produkts im Rahmen seiner Zweckbestimmung in der täglichen Routine generiert. Dadurch stehen dem Hersteller mittel- und langfristig Sicherheits- und Leistungsdaten zu seinen eigenen Produkten zur Verfügung, die es ihm ermöglichen,
Wann sind PMCF-Aktivitäten erforderlich?
Inwieweit PMCF-Aktivitäten für die einzelnen Produkte notwendig sind, hängt primär von der klinischen Datenlage zum Zeitpunkt des erstmaligen Inverkehrbringens ab. Im Rahmen der initialen klinischen Bewertung muss der Hersteller auf Basis der vorhandenen klinischen Daten und dem Ergebnis der Risikobewertung ermitteln, ob alle Fragestellungen hinsichtlich der Sicherheit und Leistungsfähigkeit ausreichend beantwortet sind oder ob sich bestimmte Fragen (z. B. Sicherheit nach längerer Anwendungsdauer) erst nach Inverkehrbringen beantworten lassen.
Können aufgrund der klinischen Datenlage bestimmte Fragestellungen nicht abschließend beantwortet werden, sind diese nach Markteinführung mittels PMCF abzuklären. Dazu gehören beispielsweise Fragen hinsichtlich:
Im weiteren Verlauf des Produktlebenszyklus sind dann die nachfolgenden PMCF-Aktivitäten an die vorliegenden aktuellen Ergebnisse der klinischen Bewertung und Risikobewertung anzupassen. Input liefern hier im Wesentlichen die aus dem PMCF und der Überwachung der Produkte nach dem Inverkehrbringen (Post-Market Surveillance, PMS) gewonnenen Daten.
Bei bereits im Markt befindlichen Produkten ist der Hersteller angehalten, die zu seinen Produkten vorliegenden klinischen Daten zu prüfen, ob sich anhand dieser die klinische Evidenz in Bezug auf den Stand der Technik für alle ausgelobten Produkteigenschaften und -leistungen, ausreichend demonstrieren lässt. Sind diese Daten in quantitativer und qualitativer Hinsicht unzureichend, sind weitere PMCF-Aktivitäten notwendig, um die vorhandenen Datenlücken zu schließen. Denn nur so werden eine „Neu“-Zertifizierung dieser Produkte gemäß MDR oder eine Verlängerung der bereits vorhandenen Zertifikate möglich sein.
Hält der Hersteller aufgrund der vorliegenden Ergebnisse aus der klinischen Bewertung und Risikobewertung weitere PMCF-Aktivitäten für nicht (mehr) erforderlich, muss er dies entsprechend begründen und im Plan zur Überwachung nach dem Inverkehrbringen (PMS-Plan), dokumentieren.
Welche PMCF Aktivitäten gibt es?
Welche PMCF-Aktivitäten für die einzelnen Produkte erforderlich sind, ist vom Hersteller in Abhängigkeit von der klinischen Datenlage selbst festzulegen. Die Benannte Stelle überprüft im Rahmen ihrer Audits, ob ein entsprechendes PMCF-Konzept beim Hersteller für die einzelnen Produkte vorhanden ist und bewertet die Angemessenheit der PMCF-Aktivitäten im Hinblick auf die aktuell vorliegende klinische Datenlage.
Die Konzepte der Hersteller reichen dabei von generellen bis hin zu spezifischen PMCF-Aktivitäten, zu denen die sogenannten PMCF-Studien gehören (siehe Abbildung).
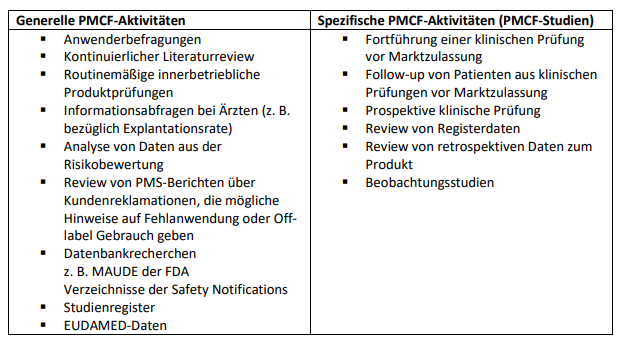
Überblick über generelle und spezifische Aktivitäten der klinischen Nachbeobachtung
Die unterschiedlichen Möglichkeiten, PMCF durchzuführen, sollten vom Hersteller vielseitig genutzt werden, um Informationen über die Sicherheit, die Leistungsfähigkeit und den Nutzen des Produkts, aus unterschiedlichsten Quellen und Blickwinkeln zu beziehen.
Bereits jetzt schon werden einfache Anwenderbefragungen von der Benannten Stelle nicht mehr als alleinige Quelle klinischer Daten akzeptiert, da sie nur einseitig klinische Daten von Anwendern oder Ärzten liefern. Deshalb werden Hersteller nicht umhinkommen, sich verschiedenste Strategien zu überlegen, die ein möglichst genaues Abbild liefern, wie sich die Produkte unter Anwendungsbedingungen verhalten.
Fester Bestandteil der generellen PMCF-Aktivitäten sollte immer ein kontinuierlicher Literaturreview sein, der es ermöglicht, vorhandene klinische Daten gleichartiger oder ähnlicher im Markt befindlicher Produkte mit zu bewerten. Solche Daten können unter anderem dazu genutzt werden, vorliegende Informationen zum Stand der Technik zu aktualisieren oder sicherheitsrelevante Aspekte weiter zu verifizieren.
Beim Verweis auf klinische Daten gleichartiger oder ähnlicher Produkte ist allerdings darauf zu achten, die hinreichende Äquivalenz zum eigenen Produkt entsprechend nachzuweisen.
Wann sind im Rahmen des PMCF Studien erforderlich?
Da der Begriff PMCF zunächst einmal nur die Methodik beschreibt, über die vom Hersteller klinische Daten gesammelt und bewertet werden, ist der Begriff PMCF nicht gleichzusetzen mit PMCF-Studien.
PMCF-Studien sind eine spezielle Art von PMCF-Aktivitäten, über die der Hersteller proaktiv und prospektiv valide klinische Daten unter systematischen, standardisierten Bedingungen generiert, die repräsentativ für eine größere Population von Patienten und Anwendern sind.
PMCF-Studien werden unter anderem von der Benannten Stelle erwartet, wenn
Für neue Medizinprodukte (z. B. neues Produktdesign, neue Anwendung, neue Technologie) oder bei Produkten, die eine der oben genannten Voraussetzungen erfüllen, dürften somit nach aktueller Sachlage PMCF-Studien unabhängig von der Risikoklasse zum Regelfall werden. Denn die in der MDR verankerte deutlich engere Auslegung des Äquivalenzprinzips dürfte dazu führen, dass allenfalls im Ausnahmefall äquivalente Produkte ausgewiesen und diesbezügliche klinische Daten zur klinischen Bewertung herangezogen werden können.
Für modifizierte implantierbare Produkte oder Produkte der Klasse III, mit einer initialen klinischen Bewertung nach dem Äquivalenzprinzip, auf Basis klinischer Daten eines Vorgängerprodukts desselben Herstellers werden PMCF-Studien sogar verpflichtend vorgeschrieben, gemäß MDR Artikel 61 (4).
Nicht erforderlich sind PMCF-Studien hingegen, wenn beim Hersteller bereits
Dennoch ist es empfehlenswert, auch in solchen Fällen, in denen der Hersteller vermeintlich keine PMCF-Studie durchführen müsste, im Vorfeld mit der Benannten Stelle abzuklären, ob diese die Einschätzung des Herstellers teilt oder gegebenenfalls doch für die Re-Zertifizierung klinische Studiendaten, in Ergänzung zu den Daten aus den generellen PMCF-Aktivitäten, erwartet.
Dokumentation der PMCF-Aktivitäten
Alle PMCF-Aktivitäten, die ein Hersteller für seine Produkte plant, sind im sogenannten PMCF-Plan zu dokumentieren. Dieser beschreibt die Methoden und Verfahren für das proaktive Sammeln und Bewerten klinischer Daten, die aus der Anwendung des Produkts im Rahmen seiner Zweckbestimmung nach Inverkehrbringen stammen.
Der PMCF-Plan ist Bestandteil des Plans für die Überwachung nach dem Inverkehrbringen (PMS-Plan) und für jedes Medizinprodukt zu erstellen. Die Benannte Stelle überprüft im Rahmen ihrer Audits, aber auch im Rahmen der Prüfungen von Technischen Dokumentationen der Produkte, ob ein entsprechender PMCF-Plan beim Hersteller vorhanden ist und ob die vom Hersteller gewählten Methoden und Verfahren geeignet sind, die Ziele des PMCF entsprechend zu erreichen.
Die über das PMCF gesammelten Daten sind, gemäß der zeitlichen Vorgaben im PMCF-Plan, anhand eines vorliegenden statistischen Analyseplan auszuwerten und im Hinblick auf die vorgesehenen Ziele des PMCF zu bewerten. Bei der Bewertung sind sowohl die positiven als auch alle negativen Ergebnisse im Hinblick auf die Sicherheit, die Leistungsfähigkeit bzw. die weitere Vertretbarkeit des Nutzen-Risiko-Verhältnisses mit in Betracht zu ziehen.
Die Ergebnisse und Schlussfolgerungen aus dem PMCF sind im sogenannten PMCF-Bewertungsbericht (PMCF Evaluation Report) zu dokumentieren. Der PMCF-Bewertungsbericht ist Bestandteil des klinischen Bewertungsberichts (Clinical Evaluation Report, CER) und der Technischen Dokumentation des Herstellers.
Sowohl für den PMCF-Plan als auch für den PMCF-Bewertungsbericht liegen seit April 2020 von der Medical Device Coordination Group (MDCG) veröffentlichte Templates (MDCG Dokumente 2020-07 und 2020-08) vor. Die Templates beschreiben basierend auf den Vorgaben der MDR die Struktur und den Inhalt der Dokumente im Detail. Sie dienen damit nicht nur den Herstellern als Leitfaden für die Erstellung, sondern auch den Benannten Stellen als Leitfaden zur Überprüfung der Technischen Dokumentation, weshalb die Vorgaben dieser beiden MDCG-Leitlinien verpflichtend umzusetzen sind.
Wofür werden die Ergebnisse aus dem PMCF benötigt?
Die aus dem PMCF gewonnenen Schlussfolgerungen sind vom Hersteller zu berücksichtigen bei der Aktualisierung
Sie tragen hier im Wesentlichen dazu bei, die Produktsicherheit, Leistungsfähigkeit und das Nutzen-Risiko-Verhältnis auf Basis der aktuell vorhandenen klinischen Daten zum Produkt zu re-evaluieren.
Durch mehr Transparenz über das Verhalten der Produkte unter Anwendungsbedingungen können Risiken oder Leistungsmängel früher vom Hersteller erkannt, eingedämmt und die Strategien zur Marktüberwachung an die aktuelle klinische Datenlage gut angepasst werden. Dies wird mittel- und langfristig gesehen die Qualität und Sicherheit der Produkte weiter steigern und Patienten und Anwender einen bestmöglichen klinischen Nutzen bieten.
Fazit
Durch den deutlich stärkeren Fokus der MDR auf die klinische Bewertung und die Forderung, diese anhand klinischer Daten kontinuierlich zu aktualisieren, wird die klinische Nachbeobachtung nach Inverkehrbringen, das sog. Post-Market Clinical Follow-up (PMCF), zu einer Art Life-Cycle-Prozess über den gesamten Produktlebenszyklus. Durch ein konsequentes PMCF stehen den Herstellern mehr und mehr klinische Daten zu ihren eigenen Produkten zur Verfügung, anhand derer die klinische Bewertung kontinuierlich nach Inverkehrbringen re-evaluiert werden kann.
Den Herstellern ist es sehr zu empfehlen, bereits im Rahmen der initialen klinischen Bewertung festzulegen, wie sie in angemessener Art und Weise PMCF für ihre Produkte implementieren und umsetzen können.
Hier ist zu beachten, dass in Abhängigkeit von den geplanten PMCF-Aktivitäten ggf. weitere personelle Kapazitäten, ein entsprechendes Budget und Know-how im Bereich klinischer Prüfungen vorhanden sein muss, um die geplanten PMCF-Aktivitäten auch angemessen durchführen zu können. Dies stellt für viele kleinere Unternehmen eine große Herausforderung dar.
Deshalb ist es ratsam, PMCF bereits bei der Produktentwicklung mit zu berücksichtigen. Denn nur wer über ausreichend klinische Daten verfügt, wird unter den Vorgaben der MDR klinische Evidenz zeigen können und die Sicherheit und Qualität seiner Produkte kontinuierlich steigern.
Erstveröffentlicht auf Medtec Online am 12.3.2021
Diskutieren Sie mit über diesen Artikel in der Meditec Online Fach-Community.
Normative Verweise:
https://eur-lex.europa.eu/legal-content/DE/TXT/?uri=CELEX%3A32017R0745
Quellen und Referenzen:
Picture: @UaPieceofCake/AdobeStock.com